研究人员质疑FDA批准Aduhelm的误导性替代证据
去年,FDA加速批准了用于治疗阿尔茨海默病的抗体 aducanumab(Biogen 以 Aduhelm 的名义销售)。该批准仅基于通过淀粉样蛋白 PET 扫描评估的大脑中蛋白质“淀粉样蛋白”数量的假定减少,并且没有显着临床效果的证据。
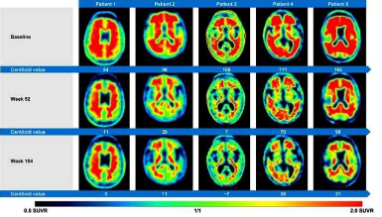
在阿尔茨海默病杂志上发表的一篇评论中,作者 Poul F. Høilund-Carlsen、Mona-Elisabeth Revheim、Abass Alavi、Nagichettiar Satyamurthy 和 Jorge R. Barrio 详细阐述了他们的观点,质疑主导阿尔茨海默病研究和治疗的淀粉样蛋白假说30年的考验。
他们特别质疑淀粉样蛋白 PET 扫描的使用,这是一种成像程序,已被用于显示新疗法是否能够减少脑淀粉样蛋白沉积,因为这被认为可以抑制阿尔茨海默氏病的发展。他们争辩说,正是这一发现促成了 FDA 批准 Aduhelm,这与其自己的独立专家小组相反,后者徒劳地寻找有利临床效果的证据。
“我们认为这种 PET 扫描是有问题的,并且误导了 FDA 做出违背该机构‘保护和促进公众健康’的首要使命的决定,”医院放射科医学博士 Abass Alavi 评论道。宾夕法尼亚大学,费城,宾夕法尼亚州,。
“批准的背景是一个从未被证实的‘淀粉样蛋白假说’,表明阿尔茨海默病是由大脑淀粉样蛋白沉积引起的。我们担心 Aduhelm 和类似药物不会减少大脑中淀粉样蛋白的数量,而是会增加脑损伤。”
Alavi 博士继续说道,“除了我们的担忧之外,我们怀疑进行的淀粉样蛋白 PET 扫描并没有反映淀粉样蛋白的去除,而是表明治疗引起的脑损伤增加。因此,我们强烈建议 FDA 将其 Aduhelm暂停批准,需要对我们的假设进行彻底调查,然后再对任何进一步的阿尔茨海默氏症免疫疗法申请采取立场。”
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
2025年6月20日,——在世界文化遗产地河南洛阳的光影流转之间,2025年新浪微博旅游之夜盛大举行。作为国内首个...浏览全文>>
-
2025年6月20日,——在世界文化遗产地河南洛阳的光影流转之间,2025年新浪微博旅游之夜盛大举行。作为国内首个...浏览全文>>
-
QQ多米试驾线下预约活动为了让更多用户感受QQ多米的独特魅力,我们特别推出了线下试驾预约活动。这不仅是一次...浏览全文>>
-
阜阳长安启源A07以其卓越的性能和豪华配置吸引了众多消费者的目光。作为一款定位高端市场的新能源车型,长安启...浏览全文>>
-
【安徽淮南大众CC新车报价2025款大公开】大众CC作为一款兼具运动感与豪华质感的轿跑车型,一直深受消费者喜爱...浏览全文>>
-
2025款长安猎手K50在安徽淮南地区的最新价格已新鲜出炉,为准备购车的朋友带来全面解析。这款车型以其高性价比...浏览全文>>
-
在安徽滁州购买长安猎手K50时,了解其落地价和省钱技巧至关重要。长安猎手K50是一款实用性强的皮卡车型,适合...浏览全文>>
-
途锐新能源是大众旗下的一款高端插电混动SUV,目前在安徽阜阳地区有售。其官方指导价约为58万元起,但实际成交...浏览全文>>
-
2025款大众CC作为一款兼具运动与豪华的中型轿车,备受关注。目前市场指导价大约在25万至35万元之间,具体价格...浏览全文>>
-
2024款探岳X作为一款备受关注的中型SUV,在市场上以其时尚的设计和出色的性能吸引了众多消费者。根据最新市场...浏览全文>>
- QQ多米试驾线下预约
- 安徽滁州长安猎手K50落地价,买车省钱秘籍
- 淮南大众CC新款价格2025款多少钱?买车攻略一网打尽
- 瑞虎8 PRO试驾,畅享豪华驾乘,体验卓越性能
- 安徽阜阳长安启源A05多少钱 2025款落地价,换代前的购车良机,不容错过
- 保时捷Macan试驾的流程是什么
- 安徽淮南大众ID.3多少钱?购车攻略在此
- 阜阳揽巡落地价,豪华配置超值价来袭
- 安徽池州威然 2024新款价格与配置的完美平衡
- 奇瑞瑞虎9试驾,新手必知的详细步骤
- QQ多米价格,换代前的购车良机,不容错过
- 池州迈腾GTE新款价格2022款多少钱?选车秘籍与优惠全公开
- 岚图追光多少钱 2024款落地价走势,近一个月最低售价25.28万起,性价比凸显
- 天津滨海威然 2024新款价格,最低售价28.98万起,入手正当时
- 蚌埠途昂新款价格2025款多少钱?购车必看
- 坦克400预约试驾全攻略
- 天津滨海ID.7 VIZZION价格,各配置车型售价全揭晓,性价比之王
- 安庆帕萨特最新价格2025款,最低售价12.35万起,入手正当时
- 亳州宝来新款价格2025款多少钱?选车指南与落地价全解析
- 生活家PHEV 2025新款价格,最低售价63.98万起现在该入手吗?
