基因组编辑iPS细胞移植可在体内传递治疗分子
诱导多能干(iPS)细胞对生物学和医学产生巨大影响,有望改善再生医学。自2014年将一片源自iPS细胞的视网膜色素上皮细胞移植到年龄相关性黄斑变性患者体内以来,已经对源自iPS细胞的各种细胞类型进行了临床试验。虽然迄今为止已使用源自健康个体的iPS 细胞,但预计未来可以通过基因改造来增强使用 iPS 细胞的移植治疗。
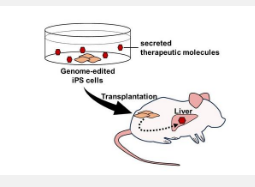
因此,我们通过利用法布里病小鼠模型作为概念证明来解决这种可能性。法布里病是由 α-半乳糖苷酶 A (GLA) 遗传缺陷引起的,导致其底物三酰神经酰胺 (Gb3) 和三酰鞘氨醇 (Lyso-Gb3) 等底物的积累。我们之前开发了一种工程酶,即修饰的 α-N-乙酰半乳糖胺酶 (mNAGA),通过将 NAGA(GLA 的旁系同源物)的底物特异性改变为 GLA 的底物特异性来治疗法布里病。由于mNAGA保持了NAGA原有的抗原性,因此这种修饰酶与GLA不存在免疫学交叉反应性,同时具有GLA酶活性。在本研究中,我们测试了通过基因组编辑移植分泌mNAGA的iPS细胞是否可以在体内提供GLA活性。
首先,我们通过 TALEN 介导的敲入 AAVS1 位点(一个安全港位点)来生成分泌 mNAGA 的 iPS 细胞。此外,为了排除患者iPS细胞内源性GLA可能引起的免疫原性反应,我们通过CRISPR-Cas9破坏了GLA基因。当无GLA活性的Fabry模型心肌细胞和成纤维细胞与分泌mNAGA的iPS细胞共培养时,表达mNAGA的细胞在体外恢复了GLA活性。
接下来,我们将分泌 mNAGA 的 iPS 细胞移植到法布里病模型小鼠的睾丸中。7或8周后,肝脏中的GLA活性显着提高,但在心脏、肾脏或血浆中未观察到活性恢复。我们还量化了肝脏中 Gb3 和 Lyso-Gb3 的量,但没有检测到底物的减少。
由于移植的iPS细胞分泌的mNAGA数量有限,肝脏中的GLA活性不足以降低Gb3或Lyso-Gb3。然而,未来或许可以通过基因组编辑来增强mNAGA的分泌量。还可以将 mNAGA 直接递送至需要 GLA 活性的器官和组织。例如,移植源自分泌mNAGA的iPS细胞的心肌细胞片,直接将mNAGA递送至心脏。此外,虽然这项研究主要针对法布里病,但同样的策略也可以应用于其他疾病。
这项研究证明了利用基因组编辑的 iPS 细胞分泌治疗分子进行细胞治疗的潜力。这些基因组编辑的 iPS 细胞不仅可以作为细胞移植的资源,还可以作为药物输送系统。
杂志
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
2025年6月20日,——在世界文化遗产地河南洛阳的光影流转之间,2025年新浪微博旅游之夜盛大举行。作为国内首个...浏览全文>>
-
2025年6月20日,——在世界文化遗产地河南洛阳的光影流转之间,2025年新浪微博旅游之夜盛大举行。作为国内首个...浏览全文>>
-
QQ多米试驾线下预约活动为了让更多用户感受QQ多米的独特魅力,我们特别推出了线下试驾预约活动。这不仅是一次...浏览全文>>
-
阜阳长安启源A07以其卓越的性能和豪华配置吸引了众多消费者的目光。作为一款定位高端市场的新能源车型,长安启...浏览全文>>
-
【安徽淮南大众CC新车报价2025款大公开】大众CC作为一款兼具运动感与豪华质感的轿跑车型,一直深受消费者喜爱...浏览全文>>
-
2025款长安猎手K50在安徽淮南地区的最新价格已新鲜出炉,为准备购车的朋友带来全面解析。这款车型以其高性价比...浏览全文>>
-
在安徽滁州购买长安猎手K50时,了解其落地价和省钱技巧至关重要。长安猎手K50是一款实用性强的皮卡车型,适合...浏览全文>>
-
途锐新能源是大众旗下的一款高端插电混动SUV,目前在安徽阜阳地区有售。其官方指导价约为58万元起,但实际成交...浏览全文>>
-
2025款大众CC作为一款兼具运动与豪华的中型轿车,备受关注。目前市场指导价大约在25万至35万元之间,具体价格...浏览全文>>
-
2024款探岳X作为一款备受关注的中型SUV,在市场上以其时尚的设计和出色的性能吸引了众多消费者。根据最新市场...浏览全文>>
- QQ多米试驾线下预约
- 安徽滁州长安猎手K50落地价,买车省钱秘籍
- 淮南大众CC新款价格2025款多少钱?买车攻略一网打尽
- 瑞虎8 PRO试驾,畅享豪华驾乘,体验卓越性能
- 安徽阜阳长安启源A05多少钱 2025款落地价,换代前的购车良机,不容错过
- 保时捷Macan试驾的流程是什么
- 安徽淮南大众ID.3多少钱?购车攻略在此
- 阜阳揽巡落地价,豪华配置超值价来袭
- 安徽池州威然 2024新款价格与配置的完美平衡
- 奇瑞瑞虎9试驾,新手必知的详细步骤
- QQ多米价格,换代前的购车良机,不容错过
- 池州迈腾GTE新款价格2022款多少钱?选车秘籍与优惠全公开
- 岚图追光多少钱 2024款落地价走势,近一个月最低售价25.28万起,性价比凸显
- 天津滨海威然 2024新款价格,最低售价28.98万起,入手正当时
- 蚌埠途昂新款价格2025款多少钱?购车必看
- 坦克400预约试驾全攻略
- 天津滨海ID.7 VIZZION价格,各配置车型售价全揭晓,性价比之王
- 安庆帕萨特最新价格2025款,最低售价12.35万起,入手正当时
- 亳州宝来新款价格2025款多少钱?选车指南与落地价全解析
- 生活家PHEV 2025新款价格,最低售价63.98万起现在该入手吗?
