先进技术揭示了细胞中锌运输的复杂细节
一组研究人员发现了一种微小但至关重要的蛋白质背后的秘密,这种蛋白质可以在我们的体内输送锌离子 (Zn 2+ )。这一发现让我们更深入地了解我们的细胞如何保持最佳健康。
Zn 2+ 可能很小,但它们在我们的细胞中发挥着强大的作用。锌能够实现酶催化、蛋白质折叠、DNA 结合和调节基因表达,我们体内大约 10% 的蛋白质依赖 Zn 2+ 才能有效发挥作用。
该研究于 2023 年 8 月 8 日发表在《自然通讯》杂志上,重点关注高尔基体——一种细胞室,负责处理、分类和将细胞分配到最终目的地。在高尔基体中,三种不同的锌转运蛋白 (ZnT) 复合物 - ZnT4、ZnT5/6 和 ZnT7 - 协作将 Zn 2+ 离子从细胞内部(细胞质)引入高尔基体。虽然人们早就知道这些复合物发挥着关键作用,但它们内部控制 Zn 2+ 运输的精确机制仍然是个谜。
该研究的通讯作者、东北大学先进材料科学研究所的教授 Kenji Inaba 表示:“我们的研究重点是转运蛋白 hZnT7。” “这项研究建立在我们之前的研究基础上,即 hZnT7 在 Zn2+ 摄取到顺式高尔基体池中发挥着至关重要的作用,并调节伴侣蛋白 ERp44 的定位、运输和功能。”
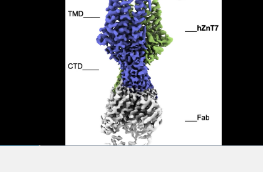
为了揭示有关 hZnT7 的更多信息,Inaba 和他的同事采用了一种称为冷冻电子显微镜 (cryo-EM) 的先进技术。两台冷冻电镜机器,一台来自东北大学,一台来自东京大学,可以捕获 hZnT7 的详细图像。通过使用特异性结合 hZnT7 的单克隆抗体的 Fab 片段,研究人员成功地以近原子分辨率确定了 hZnT7 的冷冻电镜结构,获得了对 Zn 2+ 转运机制的重要见解 。
hZnT7 与其他锌转运蛋白(包括人 ZnT8 和细菌 YiiP)之间的比较分析揭示了 hZnT7 的独特结构特征。hZnT7 作为具有不同 Zn 2+结合构型的同型二聚体的存在具有特殊意义。值得注意的是,hZnT7 拥有细长的胞质富含组氨酸环(His 环),它与跨膜金属结合位点相互作用,这是控制锌转移的重要特征。 在通过 His 环招募Zn 2+ 的过程中,hZnT7 经历了复杂的构象重排,揭示了无与伦比的锌转运机制。
众所周知,hZnT7 在膳食锌吸收和控制体内脂肪方面发挥着关键作用。当身体某些部位的锌水平下降时,可能会导致小鼠罹患前列腺癌以及我们的身体处理胰岛素的方式受到干扰等问题。
稻叶补充说,他们的发现将有助于人们更好地了解某些病原体的分子过程。“据报道,高尔基体 ZnT 转运蛋白的异常会导致糖尿病、癌症和免疫缺陷等致命疾病,因此有必要在分子和细胞水平上了解这些疾病的致病机制。”
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
