研究揭示FUS蛋白在额颞叶痴呆和肌萎缩侧索硬化症中的作用
额颞叶痴呆 (FTD) 和肌萎缩侧索硬化症 (ALS) 是两种毁灭性的神经退行性疾病。科学家们长期以来一直怀疑一种名为 FUS 的蛋白质可能在其中发挥了作用,但确切的机制仍是一个谜。Sandrine Da Cruz 教授实验室在《分子神经退行性》杂志上发表的一项新研究揭示了 FUS 蛋白在这些疾病中的行为方式,这对于潜在的治疗干预至关重要。
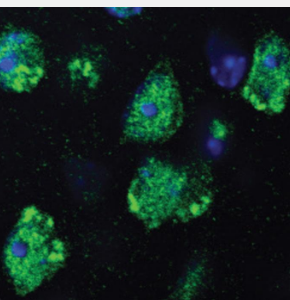
额颞叶痴呆 (FTD) 是一种早发性痴呆,约占痴呆病例的 10-20%。与主要影响记忆的阿尔茨海默病不同,FTD 的特点是因大脑额叶和颞叶退化而导致性格、行为和语言发生变化。肌萎缩侧索硬化症 (ALS) 是成人中最常见的退行性运动神经元疾病,其特征是运动神经元选择性丧失,导致进行性肌肉无力和瘫痪,以及吞咽和言语困难。患者通常在诊断后 2 至 5 年内于该疾病。每年约有 100,000 人于 ALS。
在这两种疾病中,一种名为“融合肉瘤”(FUS)的蛋白质会引起问题。正常情况下,FUS 主要存在于细胞核中,但在某些患者中,它会聚集(聚集)在细胞质中。
一项由 VIB-KU 鲁汶脑与疾病研究中心的 Sandrine Da Cruz 教授领导的新研究揭示了这些 FUS 聚集体如何扩散和行为,从而导致神经退行性变。
传播疾病
研究人员将与疾病相关的人类 FUS 聚集体注射到经过基因改造以表达人类 FUS 蛋白的小鼠体内。值得注意的是,这些聚集体就像种子一样,导致小鼠体内的内源性人类 FUS 蛋白聚集并扩散到大脑的其他区域。
“这一发现表明存在一种类似朊病的机制,即蛋白质发生错误折叠并导致其他蛋白质以类似的方式错误折叠,从而导致疾病在体内传播,”该研究的共同第一作者 Sonia Vazquez-Sanchez 博士说。“在这种情况下,错误折叠的 FUS 会聚集&luo;腐败的&ruo;健康 FUS 蛋白,从而导致有害的 FUS 聚集在整个大脑的多米诺骨牌效应。”
FUS 蛋白的聚集加剧了小鼠与年龄相关的认知衰退和行为缺陷。这一过程与人类 FTD 和 ALS 中观察到的情况相似,其中蛋白质聚集扩散并导致神经退化。
另一个重要发现是 FUS 聚集的物种屏障。当将人类 FUS 原纤维注射到仅表达小鼠 FUS 的小鼠体内时,不会发生聚集。这表明人类 FUS 蛋白之间的特定相互作用可能是聚集和扩散所必需的。
启示和未来方向
这项研究支持了更广泛的假设,即许多神经退行性疾病(包括阿尔茨海默氏症和帕金森氏症)可能涉及类似朊病的机制,即错误折叠的蛋白质通过诱导正常蛋白质中类似的错误折叠而繁殖。了解这些机制为旨在通过靶向蛋白质聚集体的扩散来阻止或减缓疾病进展的治疗策略开辟了新途径。
研究小组目前正在研究 FUS 聚集体诱发的神经的具体情况。Sandrine Da Cruz 教授总结道:“确定这些聚集体的确切成分以及受其扩散影响最大的大脑区域对于开发未来的治疗干预措施至关重要。”
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
2025年6月20日,——在世界文化遗产地河南洛阳的光影流转之间,2025年新浪微博旅游之夜盛大举行。作为国内首个...浏览全文>>
-
2025年6月20日,——在世界文化遗产地河南洛阳的光影流转之间,2025年新浪微博旅游之夜盛大举行。作为国内首个...浏览全文>>
-
QQ多米试驾线下预约活动为了让更多用户感受QQ多米的独特魅力,我们特别推出了线下试驾预约活动。这不仅是一次...浏览全文>>
-
阜阳长安启源A07以其卓越的性能和豪华配置吸引了众多消费者的目光。作为一款定位高端市场的新能源车型,长安启...浏览全文>>
-
【安徽淮南大众CC新车报价2025款大公开】大众CC作为一款兼具运动感与豪华质感的轿跑车型,一直深受消费者喜爱...浏览全文>>
-
2025款长安猎手K50在安徽淮南地区的最新价格已新鲜出炉,为准备购车的朋友带来全面解析。这款车型以其高性价比...浏览全文>>
-
在安徽滁州购买长安猎手K50时,了解其落地价和省钱技巧至关重要。长安猎手K50是一款实用性强的皮卡车型,适合...浏览全文>>
-
途锐新能源是大众旗下的一款高端插电混动SUV,目前在安徽阜阳地区有售。其官方指导价约为58万元起,但实际成交...浏览全文>>
-
2025款大众CC作为一款兼具运动与豪华的中型轿车,备受关注。目前市场指导价大约在25万至35万元之间,具体价格...浏览全文>>
-
2024款探岳X作为一款备受关注的中型SUV,在市场上以其时尚的设计和出色的性能吸引了众多消费者。根据最新市场...浏览全文>>
- QQ多米试驾线下预约
- 安徽滁州长安猎手K50落地价,买车省钱秘籍
- 淮南大众CC新款价格2025款多少钱?买车攻略一网打尽
- 瑞虎8 PRO试驾,畅享豪华驾乘,体验卓越性能
- 安徽阜阳长安启源A05多少钱 2025款落地价,换代前的购车良机,不容错过
- 保时捷Macan试驾的流程是什么
- 安徽淮南大众ID.3多少钱?购车攻略在此
- 阜阳揽巡落地价,豪华配置超值价来袭
- 安徽池州威然 2024新款价格与配置的完美平衡
- 奇瑞瑞虎9试驾,新手必知的详细步骤
- QQ多米价格,换代前的购车良机,不容错过
- 池州迈腾GTE新款价格2022款多少钱?选车秘籍与优惠全公开
- 岚图追光多少钱 2024款落地价走势,近一个月最低售价25.28万起,性价比凸显
- 天津滨海威然 2024新款价格,最低售价28.98万起,入手正当时
- 蚌埠途昂新款价格2025款多少钱?购车必看
- 坦克400预约试驾全攻略
- 天津滨海ID.7 VIZZION价格,各配置车型售价全揭晓,性价比之王
- 安庆帕萨特最新价格2025款,最低售价12.35万起,入手正当时
- 亳州宝来新款价格2025款多少钱?选车指南与落地价全解析
- 生活家PHEV 2025新款价格,最低售价63.98万起现在该入手吗?
